|
|
|
|
|
|
|
|
|
|
为做好新冠肺炎疫情防控和经济社会发展工作,支持企业复工复产,针对企业不熟悉防疫物资出口政策等实际问题,现就口罩等防疫用品出口欧盟及美国的相关准入要求及梳理的国内具有相应资质能力的认证机构名录提供如下信息指南,供企业参考。
一、欧盟对口罩等防疫用品准入要求
(一)口罩
欧盟根据用途将口罩分为两类:医用口罩和个人防护口罩。
1.医用口罩
医用口罩需按照欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)加贴CE标志,对应的标准是EN14683。根据口罩产品无菌或非无菌状态,采取的合格评定模式也不同。
(1)无菌医用口罩:必须由授权公告机构进行CE认证。
(2)非无菌医用口罩:企业只需进行CE自我符合性声明,不需要通过公告机构认证。在准备好相应文件及测试报告等资料后,即可自行完成符合性声明。
2. 个人防护口罩
个人防护口罩不属于医疗器械,但需符合欧盟个人防护设备条例EU2016/425(PPE)要求,由授权公告机构进行CE认证并颁发证书,对应的标准是EN149。
(二)防护服
防护服也分为医用防护服和个人防护服,管理要求与口罩基本类似。医用防护服按照医疗器械管理,其中无菌医用防护服需按照欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)获得CE认证,非无菌医用防护服只需进行CE自我声明。个人防护服需按照欧盟个人防护设备条例EU2016/425(PPE)获得CE认证。
(三) 欧盟公告机构查询地址
1.欧盟医疗器械指令93/42/EEC(MDD)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
2.欧盟医疗器械条例EU 2017/745(MDR)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
3.欧盟个人防护装备条例EU2016/425(PPE)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=155501
二、美国对口罩等防疫用品准入要求
(一)口罩
美国对医用口罩和防护口罩同样区分管理,其中医用口罩由美国食品药品监督管理局(FDA)管理,而个人防护口罩则由美国国家职业安全卫生研究所(NIOSH)管理。
1. 医用口罩
医用口罩需通过FDA注册,企业直接向FDA官网申请并提交相关材料。此外还有两种可选途径:
(1)已经获得NIOSH注册的N95口罩,在产品生物学测试、阻燃测试和血液穿透测试通过的情况下,可以豁免产品上市登记(510K),直接进行FDA工厂注册和医疗器械列名。
(2)如果获得持有510K的制造商的授权,可以作为其代工厂使用其510K批准号进行企业注册和器械列名。
2. 个人防护口罩
防护口罩需通过NIOSH注册,企业直接在NIOSH官网申请。
(二)防护服
对医用防护服和个人防护服的管理也类似于口罩的管理方式,其中医用防护服由美国食品药品监督管理局(FDA)管理,而个人防护服由美国国家职业安全卫生研究所(NIOSH)管理。企业直接在FDA或NIOSH进行注册申请。
三、中国境内具有口罩等防疫用品CE认证能力的认证机构名录
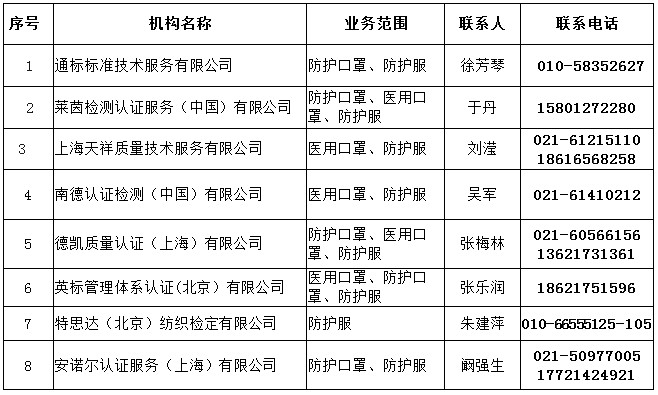
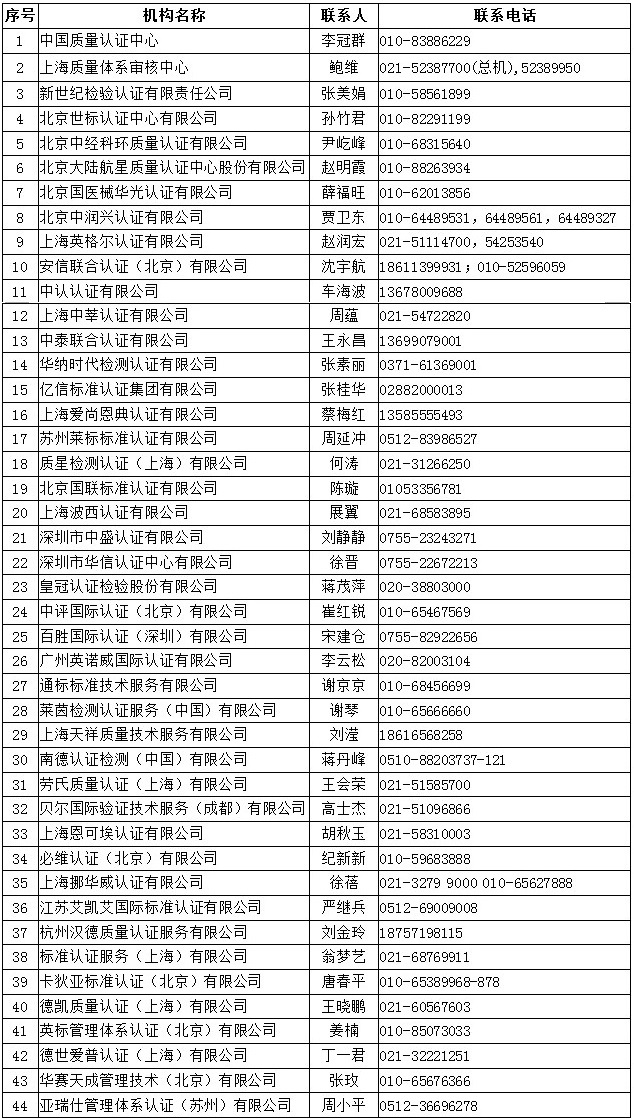
四、中国境内可以开展医疗器械管理体系(ISO13485)认证的机构名录
相关链接:一图读懂|口罩等防疫用品出口欧盟及美国市场认证信息指南